





一、质量管理体系建立的情况
a)质量管理体系建立的时间?
b)质量管理体系现行有效的版本?
c)质量管理体系的组织组织架构及部门?
d)质量管理体系修改的次数?
e)质量管理体系包括哪些文件
【示例】:程序文件:XXX份,管理制度:XXXX份,操作规程:XXXX份,操作规程:XXX份,不确定度分析评定报:告XXXX份, 期间核查管理办法:XXX份,体系运行变单:XXX份,技术记录(原始记录):XXX份,技术记录(原始报告):XXX份
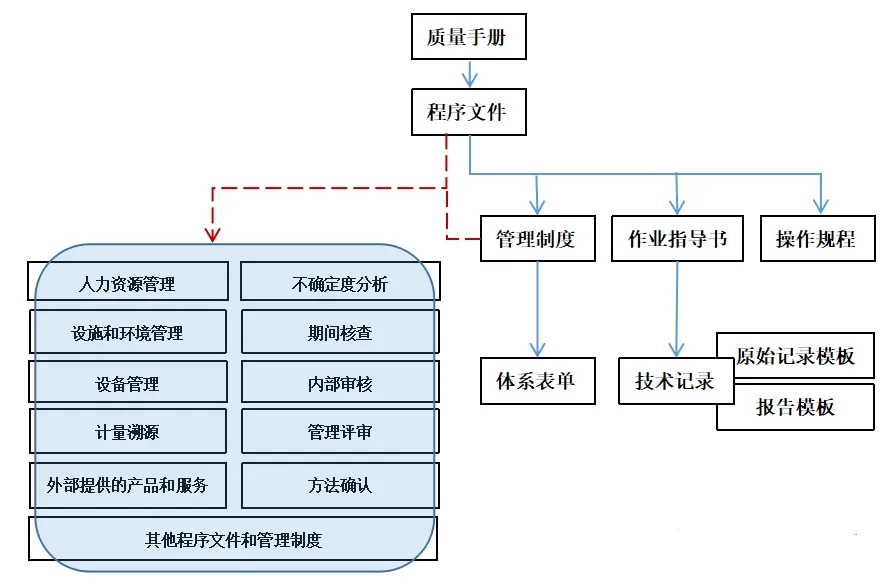
f)质量管理体系包括多少人员?
g)质量管理体系包括哪些人员?
h)申请的授权签字人是谁?
i)申请的认可领域是那些?
j)申请的认可标准有多少?
K)授权签字人、技术负责人、检测员的任职要求?
二、内审和管理评审的情况
2.1 内 审
a)内审的时间?
b)内审员是那几个?
c)内审员是否有内审员证书?
d)内审不符合项有几个?
e)内审的输出文件包括哪些?
f)内审的目的?
【答案】评价管理体系是否满足 ISO/IEC17025或其他相关准则文件的要求,即符合性检查 ;检查组织的质量手册及相关文件中的各项要求是否在工作中得到全面的贯彻,即有效的实施和保持检查。
g)内审的依据:
【答案】CNAS-CL01准则+实验室自身的管理体系要求
h)内审有什么要求?
【答案】有内审员执行+内审员不能审核自己的部门+12个月至少审核一次
i)如何开展内审工作?
【答案】(开口问题,请谨慎回答)年初制定内审计划和审核方案、审核前前一周制定审核日程表、填写首次会议签到表、填写内审检查表,填写末次会议签到表、形成内审报告,开具不符合项报告、不符合整改、不符合项整改验收、存档
2.2 管理评审
a)管理评审的时间?
b)管理评审的改进有几个?
c)管理评审的输出文件包括哪些?
d)管理评审目的:
【答案】实验室管理层评价管理体系的适宜性、充分性和有效性
e)那些人参加管理评审?
f)管理评审的输入有那些?
【答案】
a) 与实验室相关的内外部因素的变化;
b) 目标实现;
c) 政策和程序的适宜性;
d) 以往管理评审所采取措施的情况;
e) 近期内部审核的结果;
f) 纠正措施;
g) 由外部机构进行的评审;
h) 工作量和工作类型的变化或实验室活动范围的变化;
i) 客户和员工的反馈;
j) 投诉;
k) 实施改进的有效性;
l) 资源的充分性;
m) 风险识别的结果;
n) 保证结果有效性的输出;
o)其他相关因素,如监控活动和培训。
g)管理评审的输出有那些?
【答案】
a) 管理体系及其过程的有效性;
b) 履行本准则要求相关的实验室活动的改进;
c) 提供所需的资源;
d) 所需的变更。
h)管理评审的依据?
【答案】CNAS-CL01准则+实验室自身的管理体系要求
i)管理评审有什么要求?
【答案】最高管理者参加+12个月至少审核一次+先做内审再做管理评审
j)如何开展管理评审工作?
【答案】(开口问题,请谨慎回答)年初制定管理评审计划、审核前前一周各部门及个人填写管理评审输入表,审核当天填写管理评审监督表、形成管理评审报告、管理评审改进意见验证、存档
三、管理评审的要求
【答案】最高管理者参加+12个月至少审核一次+先做内审再做管理评审。
四、质量负责人的岗位职责
a)质量负责人的职责有几条?
b)质量负责人的职责如下:
【答案】(请一定要背一下)
1) 实施、保持和改进管理体系;【即:建立和实施体系】
2) 识别与管理体系或实验室活动程序的偏离;【即:识别偏离】
3) 采取措施以预防或最大程度减少这类偏离;【即:纠正偏离】
4) 向实验室管理层报告管理体系运行状况和改进需求;【即:报告体系的运行情况】
5) 确保实验室活动的有效性。【即:最终目的】
五、本实验室审核的依据
【答案】CNAS-CL01准则+实验室自身的管理体系要求
六、质量负责人如何开展工作
【答案】(开口问题,请谨慎回答)
a)熟悉质量管理体系的建立情况(参见第1章的内容)
b)熟悉内审和管理评审的实施情况(参见第2章的内容)
c)熟悉质量目标的实施情况(参见第3章的内容)
d)熟悉质量负责人的岗位职责(参见第4章的内容)
e)熟悉CNAS审核的依据(参见第5章的内容)
f)熟悉CNAS认可准则的实施情况
七、质量方针是什么
质量方针、质量方针的解释?
八、质量目标的实施情况
a)质量目标是什?
b)质量目标如何测量的?
c)质量目标写在那里?
d)质量目标如何管理的?
【答案】年度质量目标分解、每月/季度收据收集、年度质量目标汇总
九、重要的概念
1.人员监督和人员能力监控的区别
2.质量监督和质量监控的区别
3.内审和管理评审的区别
4.测量审核和能力验证、实验室比对的关系
5.方法验证和方法确认的区别
6.文件和记录的区别
十、实验室的风险主要有那些?
实验室仪器设备的问题与风险有哪些?
1.相互有影响的仪器设备放置在一起,相互干扰,数据不准。
2.仪器设备长期不校准/检定,准确性无保障。
3.仪器设备不做期间核査,性能不能掌控。
4.仪器设备无状态标识或标识混乱,容易错用。
5.仪器设备无安全保护装备,对操作员有安全风险。
6.气瓶没有分类贮存,无固定和防漏设施,有爆燃隐患。
7.仪器设备气路交叉杂乱,有火灾安全隐患。
8.仪器设备使用无记录,出现异常无法追溯。
9.仪器设备档案信息不全,对维护造成困扰。
10.仪器设备无强排风装置,对操作人员有伤害。
实验室环境控制的问题与风险有哪些?
1.操作间与仪器间无温湿度仪,实验环境条件不清楚。
2.无“三废”收集处理装置,对环境造成威胁。
3.房间墙壁脱落,地面粗糙不,杂物乱放,台面凌乱,环境感官不佳,有粉尘污染实验的危险。
4.实验室无强制通风设备,无防火、防水、防腐和急救设施,有人身安全感风险。
5.废旧和长期停用设备未清理出检测现场,有误用风险。
6.检测工作时无环境条件记录,检测结果无法复现。
7.微生物学实验室物流与人流未分开,一更、二更和三更不规范,有交叉污染风险。
8.致病性微生物实验室无生物安全装置,对操作人员有病菌感染风险。
9.相互有影响的工作空间没有有效隔离,影响检测结果准确性。
10.办公室、检测室、仪器室混用,相互交叉污染,存在安全隐患和结果准确性风险。
标准和标准物质的问题与风险有哪些?
1.标准无受控编号,标准变更后无法全部追溯变更,有错用废旧标准的风险。
2.标准长时间无查新,标准废替新发不掌握,有错用废旧标准的风险。
3.废旧标准无收回或无加盖“作费”章,有误用可能。
4.现行有效标准没有购买正式版本,有文本错误的可能。
5.新标准无宣贯记录,无法保证所有相关人员准确掌握。
6.新标准启用无审批程序和记录,技术负责人责任不到位。
7.标准物质与其它试剂混存,有交叉污染的风险。
8.标准物质无期间核查记录,标准质量不掌控,对检测结果有影响。
9.标准物质无法定证书,标准质量不保证,有结果失真风险。
10.用容量瓶贮存标准物质,有测量准确性下降的风险。
化学药品及耗材的问题与风险有哪些?
1.没有合格供应商名录,耗品质量无保障。
2.剧毒药品未实现双人双锁和使用跟踪监督制度,有剧毒药品外泄风险。
3.易制毒药品未实现双人双锁,有易制毒药品外泄风险。
4.试剂药品无领用登记、记录,试剂药品管理不到位。
5.试剂贮存与操作间同室,对检验员健康有害。
6.试剂瓶标识信息不足,试剂过期失效不掌控。
7.标准试剂配制时未在恒温恒湿条件下进行,量具热胀冷缩,标准溶液无法配准。
8.批量采购或用量大试剂未再检验验证,试剂不合格会造成巨大损失。
9.耗材质量无风险分析评估,耗材质量不合格会造成巨大损失。
10.试剂没分类贮存,有交叉污染风险;试剂室或试剂柜无强排设施,对操作员健康有害。
样品管理的问题与风险有哪些?
1.样品编号混乱,无统一唯一性编号,易混淆。
2.收样时无进样品状态描述和风险评价,出现结果异常无法追溯。
3.样品没有流转卡,样品责任不明确。
4.样品无待检、在检、已检和留样状态标识,有漏检和重检的可能。
5.样品和留样无分类贮存和监控,存在交叉污染和霉变风险。
6.检毕样品回收和处置不规范,技术负责人责任不到位。
7.样品室与办公室混用,有安全风险。
8.样品处理室与检测室混用,有交叉污染风险。
9.样品贮存无环境监控记录,有样品损毁风险。
10.样品采集过程中代表性不强,抽样记录不详,影响检测结果。
法律意识的问题与风险有哪些?
1.个别实验室名称地址、最高管理者、技术负责人变更未报发证机关办理变更手续,非独立法人实验室的法人授权书中缺少法人承担法律责任的内容。
2.未提供实验室的法律地位证明文件;实验室的检验报告专用章和仪器设备使用缺少授权文件。
3.抽查到部分检测报告在资质认定证书衔接空档期间出具。
4.部分报告不在资质认定证书核准的项目、限制范围之内。
5.缺少检验场地使用权的证明文件。
6.质量负责人、检验员等人员同时在其他单位工作。
7.实验室已发生分包,有分包协议,但在体系文件中规定不明确。
诚信服务监督的问题与风险有哪些?
1.个别实验室诚信服务制度、实验室资质、经批准的检验检测能力、办事程序、收费标准等未向客户公开。
2.无客户意见反馈地点标识及措施。
3.缺少主动征求客户意见并进行分析评价的记录资料。
4.未制定食品检验机构回避制度。
检测报告、原始记录的问题与风险有哪些?
1.部分实验室报告信息内容未按评审准则标准规范要求涵盖应有的信息,无样品状态描述,缺少所用仪器设备信息。
2.检验依据不具体不明确。
3.检验报告的技术要求栏内未填写相关检测项目的标准限值,缺少单项判定依据。
4.无结束标识,无骑缝章。
5.检验报告对应的原始记录等无编号。
6.部分检验原始记录没有填写试验日期,无制样试验人员签名,有随意涂改现象。
7.报告副本存档不完整,同一编号的委托书、抽样单、流转卡和原始记录分别归档。
8.检测报告中样品编号与“采样检验协议书/采样记录”中的样品编号不一致。
9.检测报告由非授权签字人批准。
内部审核的问题与风险有哪些?
1.个别实验室主要表现在内审计划内容不具体,未能按计划开展内部审核,内审工作没有覆盖管理体系的所有要素和部门,如管理层等。
2.内审人员未取得内审员证,内审检查表缺乏针对性,检查表中检查情况描述过于笼统,对发现的不符合项缺乏原因分析,开出的不符合项避重就轻,实际工作中存在对内部审核中发现的不符合问题未及时进行有效整改。
3.个别实验室管理评审输入不充分,对工作状况的分析不到位,评审报告敷衍了事,无评审结论,针对发现的问题不能制定有效的改进措施以及改进措施结果未得到验证。
内部监督的问题与风险有哪些?
1.监督工作在个别实验室未发挥应有的作用。主要表现在缺少监督员任命文件,监督员数量不足,监督员的专业能力不能覆盖所涉及的检测领域。
2.体系文件中无监督工作的要求和程序,未制定监督工作计划,不重视日常监督,对监督中发现的问题未分析原因制定纠正措施,或实施纠正措施后未进行效果验证。
3.一些实验室未建立和实施对在用标准进行不间断跟踪和定期清理检查的标准查新制度,检验中仍然使用过期作废标准。
4.有相当一部分实验室未做标准变更确认,未及时到资质认定管理部门办理标准变更手续。
十一、需要知晓的表单
◀公正性▶公正性承诺书、公正性检查表
◀保密性▶保密性承诺书、保密性检查表
◀人力资源▶人员汇总表、培训计划、培训记录、培训效果评价记录、岗位能力确认表、技术人员履历表、技术人员确认表、技术人员上岗证、人员能力定期确认表、员工离职承诺书、人员监督、人员能力监控
◀设备管理▶设备汇总表、维护保养计划、维护保养项目表、维护保养记录、设备点检表、设备维修记录、设备验收表、设备档案、设备购买合同和发票(非必要、最好要有)
◀计量溯源▶测量设备汇总表、校准计划、校准证书、校准结果确认表
◀顾客满意度▶顾客满意度调查表、顾客满意度汇总分析表
◀内外部环境分析▶公司环境分析报告、相关方期望或要求识别评估表
◀风险分析▶风险和机遇评估分析表、风险记录表
◀文件管理▶文件汇总表、记录汇总表、文件审批单、文件更改审批单、文件更改通知单、文件发放回收记录、外来文件目录、技术文件目录、文件定期评审表
◀合格供方▶合格供方目录、合格供方评价表
◀环境确认▶检测活动必需设施和环境条件表、设施和环境条件定期评审表、检测环境确认/再确认记录
◀安全管理▶检测环境监控记录表、实验室安全检查表、废弃物处理登记表
◀标准物质▶标准物质台账、标准物质领用记录、标准物质购买记录、标准物质期间检查记录
◀标准查新▶标准查新记录、标准清单
◀能力验证▶能力验证计划、能力验证汇总表、能力验证记录
◀质量监督▶质量监督计划、质量监督记录
◀质量监控▶质量监控计划、质量监控记录
◀内部审核▶内审计划、内审方案、内审日程表、首次会议签到表、内审检查表,末次会议签到表、内审报告,不符合项报告及整改材料
◀管理评审▶管理评审计划、管理评审输入表、管理评审报告、管理评审签到表
十二、上传到CNAS系统中的资料主要如下
附件1:实验室关键场所一览表
附件2-1:实验室授权签字人一览表
附件2-2:授权签字人申请表
附件3:实验室人员一览表
附件4:申请认可的检测能力及仪器设备(含标准物质/标准样品)配置/核查表
附件5-1:实验室参加能力验证/测量审核一览表
附件5-2:实验室参加实验室间比对一览表
附件6:《检测和校准实验室能力认可准则》核查
十三、特别强调
[请熟悉认可准则、认可准则一定要熟悉]